Cas suspect d’ebola à Ziguinchor le test est négatif, selon le ministère
 Le ministère de la Santé et de l’Action sociale a relevé dans un communiqué parvenu à notre rédaction que le test fait par l'Institut Pasteur hier, vendredi 28 Août, sur le ressortissant guinéen suspecté d’Ebola est négatif. Les services de Awa Marie Coll Seck dissipe, ainsi les inquiétudes de la population de Ziguinchor où les symptômes de la personne en question, isolée l’hôpital régional de Ziguinchor, avaient fini par hanter les populations.
Le ministère de la Santé et de l’Action sociale a relevé dans un communiqué parvenu à notre rédaction que le test fait par l'Institut Pasteur hier, vendredi 28 Août, sur le ressortissant guinéen suspecté d’Ebola est négatif. Les services de Awa Marie Coll Seck dissipe, ainsi les inquiétudes de la population de Ziguinchor où les symptômes de la personne en question, isolée l’hôpital régional de Ziguinchor, avaient fini par hanter les populations.


 CAMBRIDGE, Massachussetts, et OSAKA, Japon. - Dimanche 23 Août 2015
CAMBRIDGE, Massachussetts, et OSAKA, Japon. - Dimanche 23 Août 2015 Le Sénégal organise depuis lundi dernier, un symposium sur le thème : « prévenir l’hépatite, agir maintenant » pour marquer la journée mondiale réservée à cette maladie. A cet effet, le ministre de la Santé, Awa Marie Coll Seck, venue présider la cérémonie de clôture hier, mardi 28 juillet, a souligné que la maladie prend de l’ampleur à cause de l’ignorance des patients.
Le Sénégal organise depuis lundi dernier, un symposium sur le thème : « prévenir l’hépatite, agir maintenant » pour marquer la journée mondiale réservée à cette maladie. A cet effet, le ministre de la Santé, Awa Marie Coll Seck, venue présider la cérémonie de clôture hier, mardi 28 juillet, a souligné que la maladie prend de l’ampleur à cause de l’ignorance des patients.  L'arrivée des tests de diagnostic rapides dans les pharmacies ougandaises permet d'améliorer le traitement des patients atteints de paludisme
L'arrivée des tests de diagnostic rapides dans les pharmacies ougandaises permet d'améliorer le traitement des patients atteints de paludisme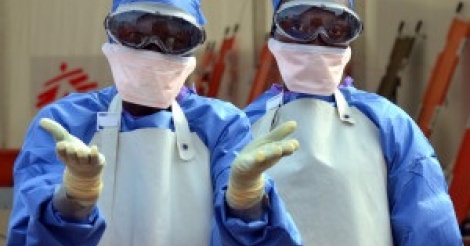 L’épidémie d’Ebola qui a frappé principalement la Guinée, la Sierra Leone et le Liberia, pourrait être vaincue d’ici la fin de l’année si tous les efforts déployés se poursuivent annonce l’Organisation mondiale de la santé (OMS). L'épidémie a touché 28 000 personnes. 11 300 sont décédées.
L’épidémie d’Ebola qui a frappé principalement la Guinée, la Sierra Leone et le Liberia, pourrait être vaincue d’ici la fin de l’année si tous les efforts déployés se poursuivent annonce l’Organisation mondiale de la santé (OMS). L'épidémie a touché 28 000 personnes. 11 300 sont décédées. CAMBRIDGE, Massachussetts (USA), et OSAKA, Japon - Mercredi 29 Juillet 2015
CAMBRIDGE, Massachussetts (USA), et OSAKA, Japon - Mercredi 29 Juillet 2015
 Le sommet Powering Africa : Nigeria se déroulera les 14 et 15 septembre prochains au Transcorp Hilton à Abuja.
Le sommet Powering Africa : Nigeria se déroulera les 14 et 15 septembre prochains au Transcorp Hilton à Abuja. Toutes les autorisations de coupe de bois données à des industriels seront retirées. L’annonce est du Président de la République, Macky Sall, qui présidait, hier vendredi 24 juillet, la clôture de la première édition de la conférence sur le développement durable. Il compte ainsi lutter contre la désertification.
Toutes les autorisations de coupe de bois données à des industriels seront retirées. L’annonce est du Président de la République, Macky Sall, qui présidait, hier vendredi 24 juillet, la clôture de la première édition de la conférence sur le développement durable. Il compte ainsi lutter contre la désertification. 

 Des pays de l’Afrique de l’Ouest, dont ceux touchés par la fièvre Ebola prennent part à un atelier ouvert mardi à Dakar, consistant à élaborer des stratégies de riposte contre les maladies à virus, sous l’égide d’Interpol, organisation internationale de police criminelle, a constaté l’Agence de presse sénégalaise (Aps).
Des pays de l’Afrique de l’Ouest, dont ceux touchés par la fièvre Ebola prennent part à un atelier ouvert mardi à Dakar, consistant à élaborer des stratégies de riposte contre les maladies à virus, sous l’égide d’Interpol, organisation internationale de police criminelle, a constaté l’Agence de presse sénégalaise (Aps). L’Agence de la couverture maladie universelle a procédé ce 14 juillet au lancement du processus de mise en œuvre de la couverture maladie universelle à travers les mutuelles de santé dans le département de Dakar. Un comité départemental de développement (Cdd) s'est tenu à cet effet à l’hôtel de ville de Dakar.
L’Agence de la couverture maladie universelle a procédé ce 14 juillet au lancement du processus de mise en œuvre de la couverture maladie universelle à travers les mutuelles de santé dans le département de Dakar. Un comité départemental de développement (Cdd) s'est tenu à cet effet à l’hôtel de ville de Dakar.